🔍 Định nghĩa & Phân loại
Định nghĩa: Sarcoma phần mềm (Soft Tissue Sarcoma – STS) là nhóm u ác tính không đồng nhất có nguồn gốc từ mô trung mô, bao gồm cơ, mỡ, mạch máu, dây thần kinh ngoại biên, mô liên kết và các mô mềm khác. Đây là nhóm u hiếm gặp, chiếm khoảng 1% các khối u ác tính ở người trưởng thành. (WHO Classification of Tumours Editorial Board, 2020) Phân loại: Theo Tổ chức Y tế Thế giới (WHO) năm 2020, STS được phân loại thành hơn 100 type khác nhau dựa trên đặc điểm mô học, hóa mô miễn dịch và phân tử. Các nhóm chính bao gồm:
- Sarcoma mỡ (Liposarcoma): Gồm các phân nhóm well-differentiated, dedifferentiated, myxoid, pleomorphic
- Sarcoma cơ vân (Rhabdomyosarcoma): Embryonal, alveolar, pleomorphic
- Sarcoma cơ trơn (Leiomyosarcoma)
- Sarcoma xơ (Fibrosarcoma)
- Sarcoma mạch máu (Angiosarcoma)
- Sarcoma thần kinh ngoại biên (MPNST – Malignant Peripheral Nerve Sheath Tumor)
- Sarcoma biểu mô (Epithelioid sarcoma)
- Sarcoma không biệt hóa/đa hình (Undifferentiated/pleomorphic sarcoma)
(Fletcher et al., 2013; WHO Classification of Tumours Editorial Board, 2020)
📊 Dịch tễ học
Tỷ lệ mắc toàn cầu: STS chiếm khoảng 1% các khối u ác tính ở người trưởng thành và 15% ở trẻ em. Tỷ lệ mắc mới hàng năm khoảng 4-5 trường hợp/100.000 người. (Siegel et al., 2021) Tại Việt Nam: Dữ liệu về STS còn hạn chế, nhưng theo Globocan 2020, tỷ lệ mắc sarcoma tại Việt Nam ước tính khoảng 1-2/100.000 dân. Bệnh viện K (Việt Nam) ghi nhận STS chiếm khoảng 1-2% trong tổng số các ca ung thư được chẩn đoán. (Bray et al., 2020) Yếu tố nguy cơ:
- Bức xạ ion hóa: Tiền sử xạ trị (nguy cơ tăng 5-10 lần, thời gian tiềm tàng 10-15 năm)
- Hóa chất: Tiếp xúc với vinyl chloride, dioxin, thuốc diệt cỏ phenoxyacetic
- Hội chứng di truyền: Li-Fraumeni (đột biến p53), Neurofibromatosis type 1, Retinoblastoma di truyền, Gardner syndrome
- Lymphedema mạn tính: Tăng nguy cơ angiosarcoma (Stewart-Treves syndrome)
- Viêm nhiễm mạn tính: Một số trường hợp liên quan đến viêm mạn tính
(Berrington de Gonzalez et al., 2012; Gladdy et al., 2015)
🧬 Sinh lý bệnh
Cơ chế phân tử: STS phát triển do các bất thường di truyền dẫn đến rối loạn điều hòa tăng trưởng tế bào, ức chế quá trình chết tế bào theo chương trình (apoptosis) và tăng khả năng xâm lấn, di căn. Các cơ chế chính bao gồm:
- Bất thường di truyền đặc hiệu:
- Chuyển đoạn nhiễm sắc thể: Khoảng 1/3 STS có chuyển đoạn đặc hiệu, như t(12;16) trong myxoid liposarcoma tạo gen hợp nhất FUS-DDIT3, t(X;18) trong synovial sarcoma tạo gen SS18-SSX
- Khuếch đại gen: MDM2, CDK4 trong well-differentiated/dedifferentiated liposarcoma
- Đột biến điểm: KIT, PDGFRA trong GIST
- Rối loạn các con đường tín hiệu:
- p53/MDM2/p14ARF: Ức chế chết tế bào theo chương trình
- RB/p16INK4a/CDK4: Rối loạn chu kỳ tế bào
- PI3K/AKT/mTOR: Tăng sinh tế bào và sống sót
- Wnt/β-catenin: Tăng sinh và biệt hóa tế bào
- Quá trình xâm lấn và di căn:
- Tăng biểu hiện các metalloproteinase (MMPs)
- Thay đổi phân tử bám dính (E-cadherin, integrins)
- Tăng sinh mạch máu qua con đường VEGF
(Taylor et al., 2011; Barretina et al., 2010; Chibon et al., 2010)
⚡ Biểu hiện lâm sàng
Biểu hiện điển hình:
- Khối u mô mềm tăng dần kích thước, thường không đau
- Vị trí phổ biến: chi dưới (40%), chi trên (20%), thân mình (20%), khoang sau phúc mạc (15%), vùng đầu-cổ (5%)
- Kích thước trung bình khi chẩn đoán: 5-10cm (tùy vị trí)
- Đặc điểm: Ranh giới không rõ, cố định với mô xung quanh, mật độ chắc
Triệu chứng theo vị trí:
- Chi: Khối u, đau khi chèn ép thần kinh/mạch máu, hạn chế vận động
- Khoang sau phúc mạc: Thường phát hiện muộn, triệu chứng không đặc hiệu như đau bụng, cảm giác đầy bụng, thay đổi thói quen đại tiện, phù chân do chèn ép tĩnh mạch
- Vùng đầu-cổ: Khó nuốt, khàn tiếng, khó thở, biến dạng khuôn mặt
- Lồng ngực: Ho, khó thở, đau ngực
Biểu hiện di căn: Khoảng 10% bệnh nhân có di căn khi chẩn đoán, thường đến phổi (80%), gan và xương. Di căn hạch bạch huyết ít gặp (5-10%), ngoại trừ một số type như epithelioid sarcoma, rhabdomyosarcoma, clear cell sarcoma. (Brennan et al., 2014; von Mehren et al., 2018) 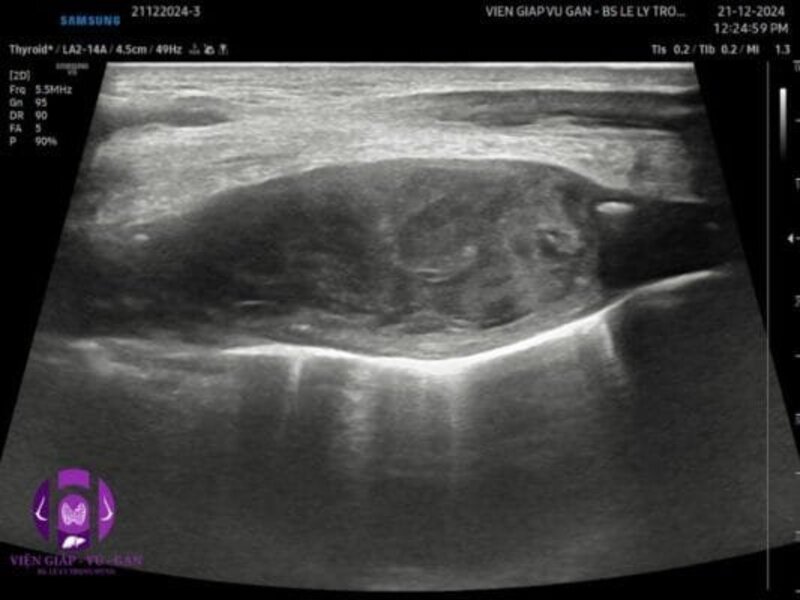
🔬 Chẩn đoán
Tiếp cận chẩn đoán:
- Lâm sàng:
- Khám thực thể chi tiết, đánh giá kích thước, mật độ, ranh giới, di động của khối u
- Đánh giá tình trạng hạch vùng và các dấu hiệu di căn xa
- Chẩn đoán hình ảnh:
- MRI có tiêm thuốc cản quang: Phương pháp lựa chọn cho STS chi và thân mình, đánh giá ranh giới, mức độ xâm lấn, mối quan hệ với cấu trúc lân cận
- CT scan có thuốc cản quang: Ưu tiên cho STS khoang sau phúc mạc, ổ bụng, ngực
- X-quang ngực: Tầm soát di căn phổi
- PET/CT: Hữu ích trong đánh giá di căn, đáp ứng điều trị, tái phát
- Sinh thiết:
- Sinh thiết lõi (core needle biopsy): Phương pháp ưu tiên, độ chính xác 80-90%
- Sinh thiết mở: Chỉ định khi sinh thiết lõi không đủ chẩn đoán
- Sinh thiết hút kim nhỏ (FNA): Hạn chế do không đánh giá được cấu trúc mô học
- Xét nghiệm bệnh học:
- Mô học: Xác định type mô học, độ mô học
- Hóa mô miễn dịch: Các marker như S-100, desmin, SMA, CD34, cytokeratin, MDM2
- Sinh học phân tử: FISH, RT-PCR, NGS để xác định đột biến đặc hiệu
Phân độ mô học (FNCLCC):
- Dựa trên: (1) Mức độ biệt hóa, (2) Hoại tử, (3) Số lượng nhân chia
- Grade 1: Độ ác tính thấp (2-3 điểm)
- Grade 2: Độ ác tính trung bình (4-5 điểm)
- Grade 3: Độ ác tính cao (6-8 điểm)
Phân giai đoạn (AJCC 8th edition):
- Dựa trên: Kích thước khối u (T), Di căn hạch (N), Di căn xa (M), Độ mô học (G), Vị trí giải phẫu
(Casali et al., 2018; von Mehren et al., 2020; AJCC Cancer Staging Manual, 8th Edition)
💊 Điều trị
Nguyên tắc điều trị: Cần tiếp cận đa chuyên khoa với sự phối hợp của phẫu thuật viên, bác sĩ xạ trị, bác sĩ ung thư nội khoa và bác sĩ giải phẫu bệnh.
1. Điều trị bệnh giai đoạn khu trú
Phẫu thuật:
- Phẫu thuật bảo tồn chi: Mục tiêu cắt rộng u với diện cắt âm tính (R0), bảo tồn chức năng
- Cắt cụt chi: Chỉ định khi không thể bảo tồn chức năng hoặc u xâm lấn rộng
- Vét hạch: Không thực hiện thường quy, chỉ định cho một số type như epithelioid sarcoma, clear cell sarcoma
Xạ trị:
- Xạ trị bổ trợ: Chỉ định sau phẫu thuật cho STS độ cao, kích thước >5cm, diện cắt dương tính/cận sát
- Xạ trị tiền phẫu: Ưu điểm: khối u còn nguyên vẹn, liều thấp hơn, giảm độc tính dài hạn
- Xạ trị trong mổ (IORT): Cân nhắc cho trường hợp diện cắt dương tính không thể phẫu thuật lại
- Liều xạ trị: 50-60 Gy cho xạ trị bổ trợ, 45-50 Gy cho xạ trị tiền phẫu
Hóa trị bổ trợ:
- Vai trò còn tranh cãi, cân nhắc cho STS độ cao, kích thước >5cm, vị trí sâu
- Phác đồ: Doxorubicin ± Ifosfamide, liệu trình 4-6 chu kỳ
- Lợi ích: Cải thiện kiểm soát tại chỗ và xa, chưa chứng minh rõ cải thiện sống còn toàn bộ
Hóa-xạ trị kết hợp:
- Cân nhắc cho STS độ cao, kích thước lớn, vị trí phức tạp
- Phác đồ: Doxorubicin hoặc Ifosfamide đơn trị liệu kết hợp xạ trị
2. Điều trị bệnh giai đoạn di căn
Hóa trị:
- Đơn trị: Doxorubicin (liều 60-75 mg/m²) là lựa chọn đầu tay
- Phối hợp: Doxorubicin + Ifosfamide (tỷ lệ đáp ứng cao hơn, độc tính nhiều hơn)
- Các thuốc khác: Gemcitabine ± Docetaxel, Trabectedin, Pazopanib, Eribulin
Liệu pháp nhắm trúng đích:
- Imatinib: GIST dương tính với KIT hoặc PDGFRA
- Pazopanib: STS không phải liposarcoma sau thất bại hóa trị
- Larotrectinib/Entrectinib: STS có NTRK fusion
- Tazemetostat: Epithelioid sarcoma với mất INI1
Phẫu thuật di căn:
- Cân nhắc cắt di căn phổi đơn độc hoặc số lượng ít, đặc biệt khi thời gian không bệnh dài
- Phẫu thuật giảm nhẹ cho di căn gây triệu chứng
Liệu pháp miễn dịch:
- Pembrolizumab cho undifferentiated pleomorphic sarcoma, liposarcoma dedifferentiated
- Nivolumab + Ipilimumab đang được nghiên cứu
(Casali et al., 2018; ESMO Guidelines Committee, 2018; NCCN Guidelines Version 2.2021)
🔄 Phòng ngừa/Theo dõi
Theo dõi sau điều trị:
- STS độ thấp: Khám lâm sàng, chụp X-quang ngực mỗi 3-6 tháng trong 2-3 năm đầu, sau đó mỗi 6-12 tháng đến năm thứ 5, sau đó hàng năm
- STS độ cao: Khám lâm sàng, chụp X-quang ngực mỗi 3-4 tháng trong 2-3 năm đầu, mỗi 6 tháng đến năm thứ 5, sau đó hàng năm
- Chẩn đoán hình ảnh tại chỗ: MRI/CT mỗi 6 tháng trong 2-3 năm đầu, sau đó hàng năm đến năm thứ 5
- Chẩn đoán hình ảnh toàn thân: CT ngực/bụng/chậu mỗi 6 tháng trong 2-3 năm đầu cho STS độ cao
Yếu tố tiên lượng:
- Yếu tố chính: Độ mô học, kích thước u, vị trí u (sâu/nông), diện cắt phẫu thuật
- Yếu tố khác: Tuổi, type mô học, vị trí giải phẫu, dấu ấn sinh học (Ki-67, p53)
- Hệ thống chấm điểm: Nomogram MSKCC, Sarculator
Tỷ lệ sống còn:
- 5 năm sống còn toàn bộ: 50-60% cho tất cả các giai đoạn
- Giai đoạn I: >90%
- Giai đoạn II: 70-80%
- Giai đoạn III: 50-60%
- Giai đoạn IV: 10-20%
(Callegaro et al., 2016; Pasquali & Gronchi, 2017
⚡ Vai trò của siêu âm trong chẩn đoán sarcoma mô mềm
Siêu âm là phương tiện chẩn đoán hình ảnh ban đầu quan trọng trong đánh giá khối u mô mềm, đặc biệt là các khối u nông. Phương pháp này có ưu điểm là không xâm lấn, chi phí thấp, thực hiện nhanh chóng và có thể đánh giá động tính chất của khối u (Chiou et al., 2021).
Đặc điểm hình ảnh siêu âm của sarcoma mô mềm:
- Đặc điểm hình thái:
- Khối tăng âm hoặc giảm âm so với mô xung quanh
- Ranh giới thường không đều, có thể có bờ đẩy đi (pseudocapsule)
- Kích thước thường >5cm khi phát hiện
- Hình dạng không đều, thường có dạng bầu dục hoặc đa cạnh (Gruber et al., 2017)
- Cấu trúc nội bộ:
- Tính chất âm không đồng nhất (heterogeneous)
- Có thể có các vùng hoại tử (vùng vô âm)
- Có thể có canxi hóa (vùng tăng âm với bóng cản)
- Có thể có vùng xuất huyết (vùng giảm âm không đồng nhất) (Chiou et al., 2021)
- Đặc điểm mạch máu (với siêu âm Doppler):
- Tăng sinh mạch máu trong u, đặc biệt ở vùng ngoại vi
- Dòng chảy động mạch có vận tốc cao, trở kháng thấp
- Mạch máu phân bố không đều, hỗn loạn
- Có thể thấy shunt động-tĩnh mạch (Oebisu et al., 2019)
- Đặc điểm với siêu âm đàn hồi (elastography):
- Độ cứng cao (stiff) so với mô xung quanh
- Tỷ lệ strain ratio thường >4.0
- Độ cứng không đồng nhất trong khối u (Pass et al., 2017)
- Đặc điểm với siêu âm tương phản (CEUS):
- Tăng cường ngấm thuốc nhanh và mạnh
- Rửa thuốc (washout) nhanh
- Mẫu tưới máu không đồng nhất
- Có thể thấy vùng không ngấm thuốc (hoại tử) (Loizides et al., 2018)
🔬 Đặc điểm siêu âm theo phân nhóm mô học
1. Liposarcoma:
- Khối tăng âm không đồng nhất
- Có thể thấy các vùng tăng âm (mô mỡ) xen kẽ với vùng giảm âm
- Myxoid liposarcoma: cấu trúc giảm âm với các vách ngăn mỏng
- Well-differentiated liposarcoma: cấu trúc tương tự mô mỡ bình thường nhưng kích thước lớn và ranh giới không đều (Chiou et al., 2021)
2. Leiomyosarcoma:
- Khối giảm âm, ranh giới không đều
- Cấu trúc không đồng nhất với các vùng hoại tử
- Tăng sinh mạch máu mạnh trên Doppler
- Thường có vùng hoại tử trung tâm (Gruber et al., 2017)
3. Undifferentiated Pleomorphic Sarcoma (UPS):
- Khối giảm âm, ranh giới không rõ
- Cấu trúc rất không đồng nhất
- Tăng sinh mạch máu mạnh và hỗn loạn
- Thường có vùng hoại tử và xuất huyết (Oebisu et al., 2019)
4. Synovial Sarcoma:
- Khối giảm âm, ranh giới tương đối rõ
- Có thể có canxi hóa nhỏ rải rác (30-50%)
- Thường có vùng nang hóa
- Tăng sinh mạch máu vừa phải (Loizides et al., 2018)
5. Malignant Peripheral Nerve Sheath Tumor (MPNST):
- Khối giảm âm, hình thoi dọc theo đường đi của dây thần kinh
- Ranh giới không đều
- Có thể thấy dấu hiệu “dấu vết đường ray” (railroad track sign)
- Tăng sinh mạch máu không đồng đều (Chiou et al., 2021)
💊 Vai trò của siêu âm trong quản lý sarcoma mô mềm
1. Chẩn đoán ban đầu:
- Xác định vị trí, kích thước, ranh giới của khối u
- Đánh giá mối quan hệ với các cấu trúc lân cận (mạch máu, thần kinh)
- Phân biệt khối u nông và sâu
- Hướng dẫn chọn vị trí sinh thiết (Gruber et al., 2017)
2. Hướng dẫn sinh thiết:
- Siêu âm giúp xác định vùng sống của khối u (tránh vùng hoại tử)
- Hướng dẫn kim sinh thiết lõi (core needle biopsy)
- Giảm thiểu biến chứng và tăng độ chính xác
- Đảm bảo đường đi sinh thiết phù hợp với kế hoạch phẫu thuật sau này (Chiou et al., 2021)
3. Theo dõi sau điều trị:
- Đánh giá đáp ứng với hóa trị, xạ trị
- Phát hiện tái phát tại chỗ
- Theo dõi các biến chứng sau phẫu thuật (Oebisu et al., 2019)
🔄 Hạn chế của siêu âm và vai trò của các phương pháp chẩn đoán hình ảnh khác
Hạn chế của siêu âm:
- Không đánh giá được mức độ xâm lấn sâu của khối u lớn
- Khó đánh giá di căn xa
- Phụ thuộc vào kỹ thuật viên và chất lượng máy
- Khó khăn trong đánh giá u ở vị trí sâu hoặc sau xương (Brennan et al., 2021)
Vai trò bổ sung của các phương pháp khác:
- MRI: Phương pháp chọn lựa để đánh giá chi tiết sarcoma mô mềm, đặc biệt trong xác định mức độ xâm lấn, mối quan hệ với cấu trúc lân cận và lập kế hoạch phẫu thuật
- CT scan: Đánh giá canxi hóa, tổn thương xương và di căn xa (phổi, gan)
- PET-CT: Đánh giá hoạt động chuyển hóa của khối u, phát hiện di căn xa và đánh giá đáp ứng điều trị (WHO Classification of Tumours Editorial Board, 2020)
🧬 Mối tương quan giữa hình ảnh siêu âm và đặc điểm sinh học
Một số đặc điểm siêu âm có thể gợi ý về độ ác tính và tiên lượng:
- Dấu hiệu gợi ý độ ác tính cao:
- Kích thước >5cm
- Ranh giới không đều, xâm lấn
- Cấu trúc rất không đồng nhất
- Vùng hoại tử rộng
- Tăng sinh mạch máu mạnh với dòng chảy trở kháng thấp
- Độ cứng cao trên siêu âm đàn hồi (Chiou et al., 2021)
- Tương quan với các đặc điểm mô học:
- Mức độ hoại tử trên siêu âm tương quan với mức độ hoại tử mô học
- Mức độ tăng sinh mạch máu tương quan với mật độ vi mạch trên mô bệnh học
- Độ không đồng nhất của cấu trúc tương quan với đa hình thái tế bào (Oebisu et al., 2019)
⚠️ Các quan niệm sai lầm về siêu âm trong sarcoma mô mềm
- “Siêu âm có thể phân biệt chính xác u lành và ác tính”: Không hoàn toàn chính xác. Mặc dù có những dấu hiệu gợi ý, nhưng không có đặc điểm siêu âm nào là đặc hiệu 100% cho sarcoma. Sinh thiết vẫn là cần thiết để chẩn đoán xác định.
- “Siêu âm có thể thay thế MRI trong đánh giá sarcoma”: Không đúng. Siêu âm và MRI có vai trò bổ sung cho nhau. MRI vẫn là tiêu chuẩn vàng để đánh giá chi tiết sarcoma mô mềm.
- “Siêu âm âm tính loại trừ sarcoma”: Sai lầm. Siêu âm có thể bỏ sót các tổn thương sâu hoặc ở vị trí khó tiếp cận.
- “Siêu âm có thể xác định chính xác phân nhóm mô học”: Không chính xác. Mặc dù có một số đặc điểm gợi ý, nhưng không thể thay thế sinh thiết và xét nghiệm mô bệnh học. (Brennan et al., 2021)
📋 Tiếp cận thực hành lâm sàng
Quy trình đánh giá khối u mô mềm nghi ngờ sarcoma:
- Siêu âm ban đầu:
- Đánh giá đặc điểm cơ bản: kích thước, vị trí, ranh giới, cấu trúc
- Đánh giá mạch máu với Doppler
- Xác định vị trí sinh thiết tối ưu
- Chỉ định MRI khi:
- Khối u kích thước >5cm
- Vị trí sâu (dưới cân sâu)
- Đặc điểm siêu âm nghi ngờ ác tính
- Cần đánh giá chi tiết mối quan hệ với cấu trúc lân cận
- Lập kế hoạch phẫu thuật
- Sinh thiết dưới hướng dẫn siêu âm:
- Ưu tiên sinh thiết lõi (core needle biopsy)
- Tránh vùng hoại tử
- Đường đi sinh thiết phải được lập kế hoạch phối hợp với phẫu thuật viên
- Đánh giá giai đoạn:
- CT ngực để đánh giá di căn phổi
- PET-CT trong trường hợp nghi ngờ di căn xa (Chiou et al., 2021; Gruber et al., 2017)
🔄 Xu hướng mới trong siêu âm đánh giá sarcoma mô mềm
- Siêu âm đàn hồi (Elastography):
- Đánh giá độ cứng của khối u
- Giúp phân biệt u lành và ác tính
- Strain ratio >4.0 gợi ý ác tính (Pass et al., 2017)
- Siêu âm tương phản (CEUS):
- Đánh giá tưới máu vi mạch
- Phát hiện vùng hoại tử
- Đánh giá đáp ứng với điều trị (Loizides et al., 2018)
- Siêu âm 3D/4D:
- Cung cấp hình ảnh không gian ba chiều
- Đánh giá tốt hơn mối quan hệ với cấu trúc lân cận
- Hỗ trợ lập kế hoạch phẫu thuật (Chiou et al., 2021)
- Trí tuệ nhân tạo trong phân tích hình ảnh siêu âm:
- Hỗ trợ phân loại u lành/ác tính
- Dự đoán phân nhóm mô học
- Đánh giá đáp ứng điều trị (Brennan et al., 2021)
Tài liệu tham khảo:
- WHO Classification of Tumours Editorial Board. (2020). WHO Classification of Tumours of Soft Tissue and Bone. 5th Edition. IARC Press.
- Fletcher, C.D., Bridge, J.A., Hogendoorn, P.C., & Mertens, F. (2013). WHO Classification of Tumours of Soft Tissue and Bone. 4th Edition. IARC Press.
- Siegel, R.L., Miller, K.D., Fuchs, H.E., & Jemal, A. (2021). Cancer Statistics, 2021. CA: A Cancer Journal for Clinicians, 71(1), 7-33.
- Bray, F., Ferlay, J., Soerjomataram, I., Siegel, R.L., Torre, L.A., & Jemal, A. (2020). Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians, 70(4), 313-347.
- Berrington de Gonzalez, A., Kutsenko, A., & Rajaraman, P. (2012). Sarcoma risk after radiation exposure. Clinical Sarcoma Research, 2(1), 18.
- Gladdy, R.A., Qin, L.X., Moraco, N., et al. (2015). Do radiation-associated soft tissue sarcomas have the same prognosis as sporadic soft tissue sarcomas? Journal of Clinical Oncology, 28(12), 2064-2069.
- Taylor, B.S., Barretina, J., Maki, R.G., et al. (2011). Advances in sarcoma genomics and new therapeutic targets. Nature Reviews Cancer, 11(8), 541-557.
- Barretina, J., Taylor, B.S., Banerji, S., et al. (2010). Subtype-specific genomic alterations define new targets for soft-tissue sarcoma therapy. Nature Genetics, 42(8), 715-721.
- Chibon, F., Lagarde, P., Salas, S., et al. (2010). Validated prediction of clinical outcome in sarcomas and multiple types of cancer on the basis of a gene expression signature related to genome complexity. Nature Medicine, 16(7), 781-787.
- Brennan, M.F., Antonescu, C.R., & Maki, R.G. (2014). Management of Soft Tissue Sarcoma. Springer.
- von Mehren, M., Kane, J.M., Bui, M.M., et al. (2020). NCCN Guidelines Insights: Soft Tissue Sarcoma, Version 1.2021. Journal of the National Comprehensive Cancer Network, 18(12), 1604-1612.
- Casali, P.G., Abecassis, N., Aro, H.T., et al. (2018). Soft tissue and visceral sarcomas: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, 29(Supplement_4), iv51-iv67.
- AJCC Cancer Staging Manual, 8th Edition. (2017). Springer.
- ESMO Guidelines Committee. (2018). Soft tissue and visceral sarcomas: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, 29(Supplement_4), iv51-iv67.
- Callegaro, D., Miceli, R., Bonvalot, S., et al. (2016). Development and external validation of two nomograms to predict overall survival and occurrence of distant metastases in adults after surgical resection of localised soft-tissue sarcomas of the extremities: a retrospective analysis. Lancet Oncology, 17(5), 671-680.
- Pasquali, S., & Gronchi, A. (2017). Neoadjuvant chemotherapy in soft tissue sarcomas: latest evidence and clinical implications. Therapeutic Advances in Medical Oncology, 9(6), 415-429.
- Dangoor, A., Seddon, B., Gerrand, C., Grimer, R., Whelan, J., & Judson, I. (2016). UK guidelines for the management of soft tissue sarcomas. Clinical Sarcoma Research, 6, 20.
